Rượu etylic (công thức chất hóa học C2H6O) nhận được sau quy trình lên men gạo, sắn, ngô (đã nấu nướng chín) hoặc nho, táo… Hãy nằm trong dò thám hiểu đặc điểm, cấu trúc phân tử, phần mềm và pha chế rượu etylic. hóa học này.
Rượu etylic là gì?
Rượu etylic (rượu etylic hoặc etanol) là 1 trong hóa học lỏng ko color, còn được gọi là rượu ngũ ly hoặc rượu, là 1 trong ăn ý hóa học cơ học vô sản phẩm đồng đẳng của rượu, dễ dàng cháy, một trong mỗi loại rượu phổ cập. chứa chấp vô bộ phận của thức uống sở hữu hễ.
Bạn đang xem: ruou etylic la gi
-
Công thức phân tử: C2H6O
-
Khối lượng phân tử: 46
-
Cấu trúc phân tử:
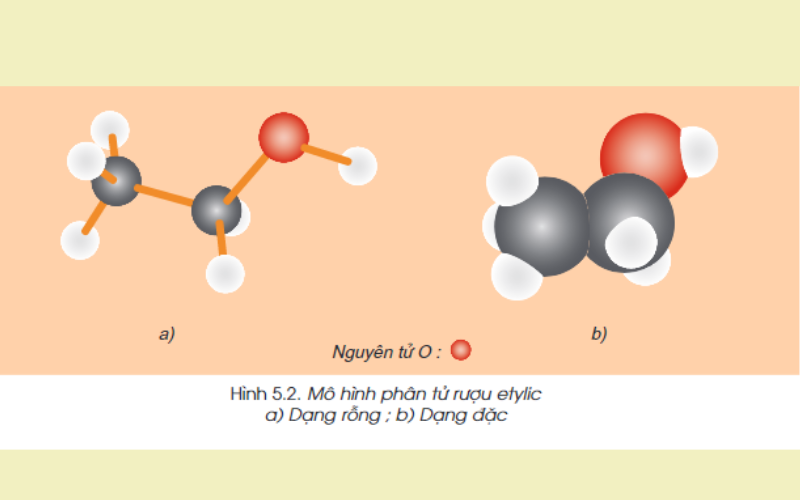
Công thức cấu trúc rút gọn: CH3-CH2-OH
Trong phân tử ancol etylic sở hữu nguyên vẹn tử H ko link với nguyên vẹn tử C nhưng mà link với nguyên vẹn tử Oxy tạo nên trở thành group -OH. Chính group -OH này đang được tạo nên mang đến rượu những đặc điểm chất hóa học đặc thù.
Tính hóa học vật lí của rượu etylic
Rượu etylic (C2H6O) sở hữu những đặc điểm cơ vật lý sau:
-
Rượu etylic là chất lỏng ko color, sôi ở 78,3 phỏng C, nhẹ nhàng rộng lớn nước, tan vô hạn nội địa.
-
Rượu etylic hòa tan được không ít chất như iot, benzen,…
-
Số ml rượu etylic sở hữu vô 100ml láo lếu ăn ý rượu và nước gọi là phỏng mạnh mẽ của rượu. Ví dụ 100ml rượu 45 phỏng chứa chấp 45ml rượu etylic nguyên vẹn hóa học.
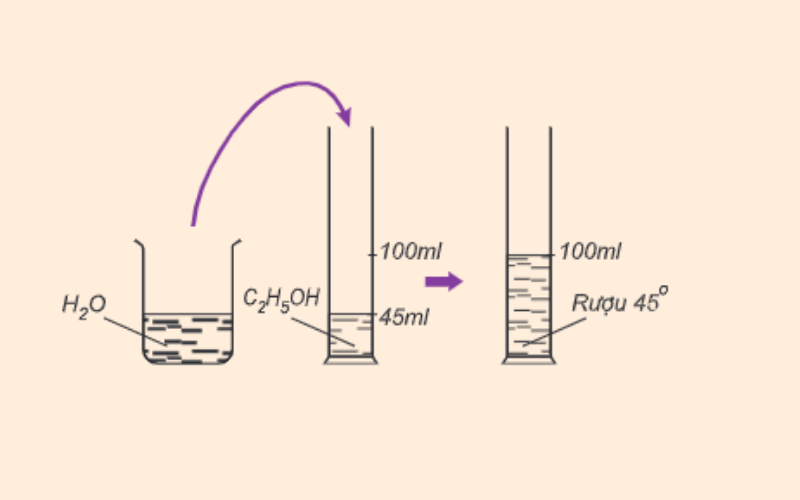
Công thức tính phỏng hễ như sau:
Độ hễ = Vr/Vhh x 100
Trong đó:
-
dr là phỏng hễ (độ)
-
Vr là thể tích rượu etylic (ml)
-
Vhh là thể tích của láo lếu ăn ý rượu và nước (ml)
Công thức tính mật độ hễ hoàn hảo là mật độ hễ = 100%. Độ rượu càng rộng lớn thì hỗn hợp chứa được nhiều rượu etylic và ngược lại.
Tính Hóa chất của rượu etylic
Với Đặc điểm link như bên trên, rượu etylic sở hữu 3 đặc điểm chất hóa học đặc thù được minh chứng qua loa thử nghiệm cụ thể sau:

Phản ứng mạnh với oxi Khi đun nóng
Ta tổ chức thử nghiệm nhỏ vài ba giọt rượu etylic vô ly sứ rồi thắp. Khi thắp cháy rượu etylic tao tiếp tục thấy ngọn lửa greed color và lan nhiều nhiệt độ. Lúc này, rượu etylic phản xạ mạnh với oxi Khi đun lạnh lẽo, tạo nên trở thành phản xạ cháy.
Phản ứng xẩy ra theo đòi phương trình sau:
C2H6O (l) + 3O2 (k) (nhiệt độ) → 2CO2 (k) + 3H2O (h)
Phản ứng với natri
Ta tổ chức thử nghiệm cho 1 kiểu natri vô ly (ống nghiệm) đựng rượu etylic. Quan sát thử nghiệm bên trên tao thấy sở hữu lớp bọt do khí tạo ra cất cánh rời khỏi, kiểu natri tan dần dần. Do bại liệt, tương tự nước, rượu etylic phản xạ với natri, giải hòa khí hydro.
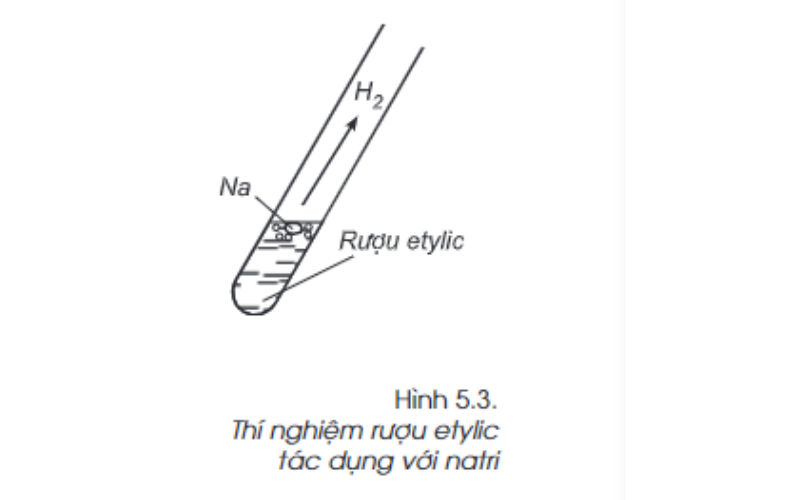
Phản ứng ra mắt như sau:
2C2H5OH(l) + 2Na(r) → 2C2H5ONa(dd) + H2(k)
Rượu này rất có thể phản xạ chất hóa học với sắt kẽm kim loại mạnh như K hoặc Na.
Phản ứng với axit axetic
Ta tổ chức thử nghiệm mang đến ancol etylic, axit axetic vô ống thử A. Thêm một không nhiều axit sunfuric quánh thực hiện xúc tác. Đun sôi láo lếu ăn ý một khi thì tạm dừng. Thêm một lượng nước vô phần khá nước dừng tụ vô ống thử B, rung lắc nhẹ nhàng rồi để ý.
Ta tiếp tục để ý hiện nay tượng: Trong ống thử B sở hữu hóa học lỏng ko color, mùi hương thơm ngát, ko tan nội địa, nổi bên trên mặt mũi nước. Chứng tỏ rượu etylic thuộc tính với axit axetic tạo nên etyl axetat. Đây là hóa học lỏng, sở hữu mùi hương thơm ngát, không nhiều tan nội địa, được sử dụng thực hiện dung môi vô công nghiệp.
Phản ứng ra mắt như sau:
C2H5OH + CH3COOH CH3COOC2H5 + H2O ( H2S04 quánh, nhiệt độ độ)
Hai cơ hội pha chế rượu etylic
Tùy theo đòi yêu cầu của tất cả chúng ta nhưng mà rượu etylic sở hữu 2 cơ hội điều chế như sau:

Cách 1: Rượu etylic được điều chế bên dưới dạng nước giải khát
Để pha chế rượu thực hiện nước giải khát, người tao kết hợp tinh nghịch bột hoặc glucozơ, nhờ men xúc tác nhận được rượu etylic theo đòi phương trình sau:
Tinh bột/đường (men) —> Rượu etylic
Phương pháp 2: Sản xuất hễ công nghiệp
Để pha chế rượu sử dụng vô công nghiệp, người tao mang đến etilen vô nước sở hữu xúc tác axit theo đòi phương trình sau:
CH2 = CH2 + H2O (axit) → C2H5OH
Xem thêm: truyện sắc dục
Chú ý: Các ăn ý hóa học cơ học, phân tử sở hữu group OH, sở hữu công thức phân tử cộng đồng là CnH2n+1OH, được gọi là rượu hoặc ankanol đơn chức, cũng đều có đặc điểm tương tự động rượu etylic.
Ứng dụng của rượu etylic
Rượu etylic, ngoài hiệu quả phổ cập nhất là thức uống, còn tồn tại những hiệu quả bổ sung cập nhật cần thiết sau.

-
Là vật liệu nhằm sản xuất dược phẩm , hễ, cao su thiên nhiên tổ hợp, axit axetic.
-
Rượu etylic được sử dụng thực hiện dung môi điều chế vecni , nước hoa.
-
Được dùng thực hiện nhiên liệu cồn (thường được trộn với xăng) và trong vô số nhiều tiến độ công nghiệp không giống. Rượu etylic cũng rất có thể được dùng trong những thành phầm kháng tấp nập tự điểm ngừng hoạt động thấp đặc thù của chính nó.
-
Dung dịch chứa chấp hễ etylic 70% được dùng thực hiện chất khử trùng , gel rửa sạch kháng trùng phổ cập nhất ở mật độ 62%. Cồn etylic được dùng làm khử trùng rất hay khi sử dụng ở hỗn hợp khoảng chừng 70%, mật độ cao hơn nữa hoặc thấp hơn nữa thì kĩ năng kháng trùng xoàng rộng lớn. Rượu etylic giết mổ bị tiêu diệt loại vật đa số bằng phương pháp thực hiện trở nên tính protein và hòa tan hóa học rộng lớn của bọn chúng. Trong khi, nó sở hữu hiệu suất cao ngăn chặn vi trùng và nấm cùng theo với nhiều loại vi-rút tuy nhiên không nhiều hiệu suất cao rộng lớn so với bào phong thủy trùng.
Bài tập luyện rượu etylic SGK Hóa học tập 9 sở hữu lời nói giải
Từ những kỹ năng và kiến thức về ancol etylic (C2H6O) phía trên, những em rất có thể áp dụng những kỹ năng và kiến thức bại liệt nhằm giải một trong những bài bác tập luyện cơ bạn dạng vô SGK chất hóa học 9 tại đây.

Giải bài bác 1 trang 139 SGK Hóa học tập 9
Rượu etylic thuộc tính với natri vì:
A. Phân tử có một nguyên vẹn tử oxi.
B. Trong phân tử sở hữu nguyên vẹn tử hiđro và nguyên vẹn tử oxi.
C. Trong phân tử sở hữu nguyên vẹn tử cacbon, hiđro và oxi.
D. Trong phân tử sở hữu group –OH.
Câu vấn đáp khêu ý:
Đáp án: D. Đáp án A, B, C sai.
Giải bài bác 2 SGK Hóa 9 trang 139
Trong số những hóa học sau: CH3 – CH3, CH3 – CH2OH, C6H6, CH3 – O – CH3 hóa học này phản xạ được với Na? Viết phương trình chất hóa học.
Câu vấn đáp khêu ý:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
Giải bài bác 3 SGK Hóa học tập 9 trang 139
Có phụ vương ống nghiệm: ống 1 đựng rượu etylic, ống 2 đựng rượu 96o, ống 3 đựng nước. Cho Na dư vô những ống thử bên trên, viết lách những phương trình chất hóa học.
Câu vấn đáp khêu ý:
Phương trình phản xạ hóa học:
Ống 1: Rượu etylic thuộc tính với Na
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Ống 2: Cồn 96o phản xạ với Na bao gồm C2H5OH và H2O phản xạ với Na
2H2O + 2Na → 2NaOH + H2
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Ống 3: Nước phản xạ với Na
2H2O + 2Na → 2NaOH + H2
Giải bài bác 4 trang 139 SGK Hóa học tập 9
Trên chai rượu sở hữu viết số, ví dụ 45 phỏng, 18 phỏng, 12 phỏng.
a) Giải mến ý nghĩa sâu sắc của những số bên trên.
b) Tính số ml rượu etylic sở hữu vô 500ml chai rượu 45 phỏng.
c) Từ 500ml rượu 45 phỏng trộn được từng nào lít rượu 25 phỏng.
Câu vấn đáp khêu ý:
a) Các số 45 phỏng, 18 phỏng, 12 phỏng cho biết thêm vô 100ml sở hữu 45ml, 18ml, 12ml rượu nguyên vẹn hóa học.
b) Số ml rượu etylic sở hữu vô 500ml rượu 45o là: (500 x 45)/100 = 225ml
c) 900ml = 0,9 lít
Xem thêm: xuyên thành phản diện phải làm sao sống đây chap 1
Theo câu b): Trong 500ml rượu 45o sở hữu 225ml rượu nguyên vẹn hóa học.
⇒ Số ml rượu 25o trộn được kể từ 500ml rượu 45o (hoặc kể từ 225ml rượu nguyên vẹn chất) là: (225 x 100)/25 = 900ml
Bài viết lách bên trên đang được hỗ trợ tương đối đầy đủ vấn đề về đặc điểm, cấu trúc phân tử, phần mềm và pha chế rượu etylic (C2H6O) – một hóa học vô nằm trong phổ cập xung xung quanh tất cả chúng ta. Hi vọng những vấn đề này sẽ hỗ trợ chúng ta đạt thêm những kỹ năng và kiến thức có lợi và vận dụng bọn chúng vô tiếp thu kiến thức gần giống vô thực tiễn.








Bình luận